Immunothérapie : prédire l’efficacité d’un traitement
A Gustave-Roussy, une équipe de chercheurs utilise l’intelligence artificielle pour déterminer un score prédictif de l’efficacité d’un traitement par immunothérapie chez des patients atteints d’un cancer.
Villejuif (Val-de-Marne) : en enfilade dans un long couloir aveugle de Gustave-Roussy, premier centre européen de lutte contre le cancer, huit accélérateurs de radiothérapie émettent chaque jour en faisceaux leurs rayons sur des centaines de patients méticuleusement positionnés sur une table de traitement, entièrement investis dans la guerre contre leurs tumeurs.
A quelques mètres de cette impressionnante routine, une équipe de médecins et chercheurs livre, elle aussi, à un autre niveau, une bataille féroce contre la maladie.
Son objectif : développer ses connaissances sur une nouvelle piste thérapeutique, l’immunothérapie, notamment pour envisager sa combinaison avec la radiothérapie, utilisée depuis de nombreuses années chez plus de la moitié des personnes souffrant d’un cancer. Autour du Pr Eric Deutsch, chef du département de radiothérapie, cette équipe a publié, en août 2018, dans la prestigieuse revue médicale The Lancet Oncology, les résultats d’une étude inédite. Elle a ainsi développé, en coopération avec CentraleSupélec, la start-up TheraPanacea, l’Inserm et l’université Paris-Sud, un modèle permettant de prédire la réponse d’un patient à un traitement d’immunothérapie. « Les tumeurs peuvent renfermer des globules blancs, les lymphocytes T, qui sont les principaux acteurs de la réponse immunitaire. Mais ceux-ci sont inhibés par les cellules cancéreuses. En les réveillant, l’immunothérapie restaure la capacité du corps à éliminer ces dernières. En ce sens, c’est un traitement relativement physiologique », résume Eric Deutsch.
Quelle réponse clinique ?
Mais, qu’il s’agisse des mélanomes, des cancers du rein, des poumons, de la sphère oto-rhino-laryngologique ou de la vessie, cette thérapie ne fonctionne que dans 15 à 30 % des cas. D’où l’intérêt de pouvoir identifier préalablement les patients susceptibles d’y répondre favorablement. Le postulat de départ est le suivant : on sait qu’il existe deux catégories de tumeurs. D’une part, les tumeurs dites « chaudes », riches en lymphocytes T, que l’on va pouvoir réactiver pour les pousser à combattre les cellules tumorales. D’autre part, les tumeurs « froides », pauvres en cellules tueuses, et pour lesquelles ce traitement sera sans doute inutile. Mais peut-on opérer cette sélection sur la base d’un simple scanner, évitant ainsi des biopsies invasives ?
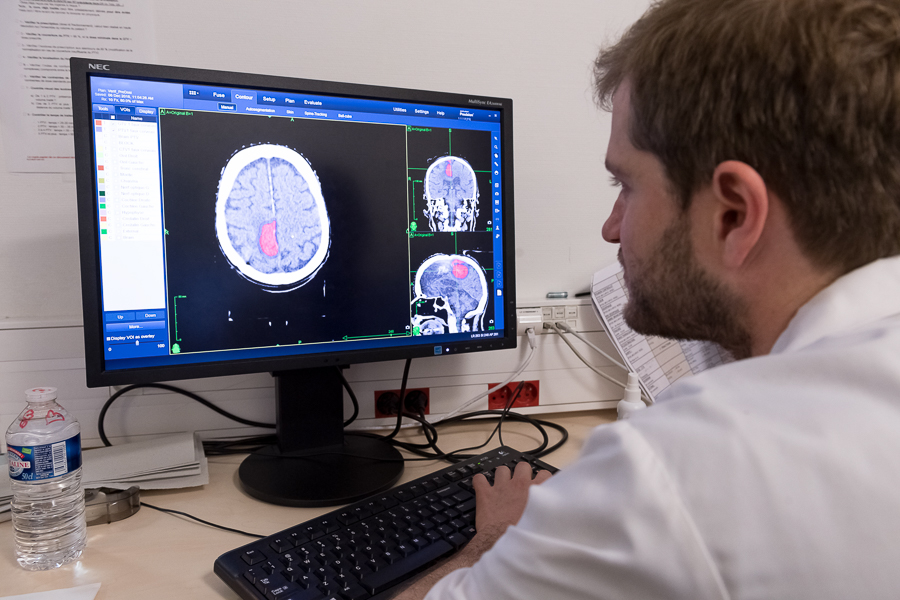
C’est tout l’enjeu de l’algorithme mis au point par ces médecins, chercheurs et ingénieurs. Ils ont en effet entraîné et validé un modèle, à partir d’une base de données de 135 patients de Gustave-Roussy, dans le but d’établir des corrélations entre les scanners de ces malades, leurs biopsies, le profilage génétique de leurs tumeurs, ainsi que leurs réponses à un traitement par immunothérapie.
Résultat : « Les scanners contiennent effectivement des informations qui vont bien au-delà de ce que l’on y cherche habituellement, c’est-à-dire, traditionnellement, la taille d’une tumeur, la proximité de vaisseaux sanguins, l’envahissement des ganglions… Outre l’organisation des tissus, on s’aperçoit qu’ils renseignent également sur leur microenvironnement et leur composition cellulaire », décrit le chef du département de radiothérapie.
Caractéristiques subtiles
Autant de « caractéristiques très subtiles, que l’intelligence artificielle est capable de sélectionner dans le but de répondre à une question clinique », indique Nikos Paragios, professeur de mathématiques à CentraleSupélec et fondateur de TheraPanacea.
« Nous savons à présent associer une image à une concentration en lymphocytes T dans une lésion, complète Charlotte Robert, maître de conférences en physique médicale à l’université Paris-Sud. Et l’on sait que, plus ils sont nombreux, plus il sera possible de les réactiver, et plus le malade est susceptible de répondre à l’immunothérapie. »
En ce sens, démontrer la présence d’informations biologiques dans des images ouvre un champ immense en termes de biomarqueurs tumoraux, autrement dit d’indicateurs de réponse de la maladie.
« Concrètement, explique le Dr Roger Sun, radiothérapeute à Gustave-Roussy, l’algorithme se nourrit d’un ensemble considérable de données brutes et produit une “signature radiomique”, à savoir un score prédisant la réponse clinique à l’immunothérapie. »
Outil prédictif
« L’analyse combinée d’un grand nombre de données, qui appartiennent à des espaces disparates, comme un séquençage génomique, un scanner, l’historique du patient, son histologie, n’est pas réalisable par le cerveau humain, assure Nikos Paragios. L’homme interprète une situation en fonction d’un système de règles, selon une démarche “logic driven”, c’est-à-dire basée sur la logique. L’intelligence artificielle, l’IA, ne cherche pas à reproduire la manière dont nous prenons les décisions, mais obéit à un fonctionnement “data driven”, guidé par les données. D’où sa capacité à identifier des corrélations qui échappent à notre concept de logique, sur des espaces de très grande dimension, sur lesquels nous sommes incapables de raisonner. »
Choix thérapeutique
Pour cette start-up, qui vient de créer avec Gustave-Roussy et CentraleSupélec un laboratoire de recherche commun alliant leurs expertises en oncologie, en radiothérapie et en intelligence artificielle, la valeur ajoutée de l’IA porte davantage sur le pronostic et le prédictif que sur les outils de diagnostic. « Tout simplement parce que c’est là qu’il est question de choix thérapeutique. Ce choix est crucial pour la santé du patient. Cela soulève également la question du coût des thérapies anti-cancer, commente Nikos Paragios. Dans le cas de l’immunothérapie, le prix d’un traitement peut s’élever à 100 000 euros. Lorsque l’on sait que seul un patient sur cinq y répond, cela signifie que l’on peut actuellement engager 500 000 euros pour ne guérir qu’une personne. On mesure alors bien l’enjeu d’identifier les malades à qui il est pertinent de proposer cette thérapie. Tout en évitant que les autres ne perdent un temps précieux dans leur course contre la montre. »
Une signature par organe
Beaucoup moins invasif qu’un prélèvement de tissu, le recours à l’imagerie permet en outre de disposer d’une cartographie complète du patient, en trois dimensions. « Sans compter que, si le malade est atteint de trois lésions, il n’est pas question de biopsier les trois, fait valoir Eric Deutsch. En revanche, des scanners peuvent être effectués régulièrement, pour surveiller les évolutions tout au long de la séquence thérapeutique et poursuivre de manière dynamique l’adaptation du traitement. »
Cette étude, qui fait le lien entre une imagerie, des informations de biologie moléculaire et une réponse clinique, a été conduite au cours des trois dernières années. « Nous avons apporté la preuve de concept, conclut Roger Sun, mais ces travaux restent généralistes, car ils portent sur des patients atteints de tous types de tumeurs. Il nous faut à présent raffiner ces signatures par organe, pour déterminer des scores par pathologie, ce que nous nous apprêtons à faire avec des financements de la Fondation pour la recherche médicale, la FRM, et de la Fondation ARC pour la recherche sur le cancer. La précision que nous visons permettra de mieux appréhender à l’avenir les associations possibles entre radiothérapie et immunothérapie. » •